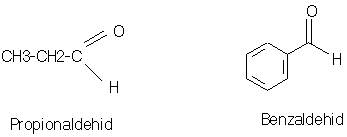Disebut Hidrokarbon : mengandung unsur C dan H
Terdiri dari : 1. Alkana (CnH2n+2)
2. Alkena (CnH2n)
3. Alkuna (CnH2n-2)
ALKANA
q Hidrokarbon jenuh (alkana rantai lurus dan siklo/cincin alkana)
q Disebut golongan parafin : affinitas kecil (=sedikit gaya gabung)
q Sukar bereaksi
q C1 – C4 : pada t dan p normal adalah gas
q C4 – C17 : pada t dan p normal adalah cair
q > C18 : pada t dan p normal adalah padat
q Titik didih makin tinggi : terhadap penambahan unsur C
q Jumlah atom C sama : yang bercabang mempunyai TD rendah
q Kelarutan : mudah larut dalam pelarut non polar
q BJ naik dengan penambahan jumlah unsur C
q Sumber utama gas alam dan petrolium
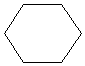
Struktur ALKANA : CnH2n+2 CH3-CH2-CH2-CH2-CH2-CH3 (heksana)
sikloheksana
PEMBUATAN ALKANA :
Ø Hidrogenasi senyawa Alkena
Ø Reduksi Alkil Halida
Ø Reduksi metal dan asam
PENGGUNAAN ALKANA :
ä Metana : zat bakar, sintesis, dan carbon black (tinta,cat,semir,ban)
ä Propana, Butana, Isobutana : zat bakar LPG (Liquified Petrolium Gases)
ä Pentana, Heksana, Heptana : sebagai pelarut pada sintesis
Fraksi tertentu dari Destilasi langsung Minyak Bumi/mentah
TD (oC) | Jumlah C | Nama | Penggunaan |
< 30 | 1 - 4 | Fraksi gas | Bahab bakar gas |
30 - 180 | 5 -10 | Bensin | Bahan bakar mobil |
180 - 230 | 11 - 12 | Minyak tanah | Bahan bakar memasak |
230 - 305 | 13 - 17 | Minyak gas ringan | Bahan bakar diesel |
305 - 405 | 18 - 25 | Minyak gas berat | Bahan bakar pemanas |
Sisa destilasi :
1. Minyak mudah menguap, minyak pelumas, lilin dan vaselin
2. Bahan yang tidak mudah menguap, aspal dan kokas dari m. bumi
ALKENA
q Hidrokarbon tak jenuh ikatan rangkap dua
q Alkena = olefin (pembentuk minyak)
q Sifat fisiologis lebih aktif (sbg obat tidur) : 2-metil-2-butena
q Sifat sama dengan Alkana, tapi lebih reaktif
STRUKTUR ALKENA : CnH2n CH3-CH2-CH=CH2 (1-butena)
ETENA = ETILENA = CH2=CH2
q Sifat-sifat : gas tak berwarna, dapat dibakar, bau yang khas, eksplosif dalam udara (pada konsentrasi 3 – 34 %)
q Terdapat dalam gas batu bara biasa pada proses “cracking”
q Pembuatan : pengawahidratan etanaol
PENGGUNAAN ETENA :
ä Dapat digunakan sebagai obat bius (dicampur dengan O2)
ä Untuk memasakkan buah-buahan
ä Sintesis zat lain (gas alam, minyak bumi, etanol)
PEMBUATAN ALKENA :
Ø Dehidrohalogenasi alkil halida
Ø Dehidrasi alkohol
Ø Dehalogenasi dihalida
Ø Reduksi alkuna
ALKUNA
q Hidrokarbon tak jenuh mempunyai ikatan rangkap tiga
q Sifat-sifatnya menyerupai alkena, tetapi lebih reaktif
Struktur ALKUNA : CnH2n-2 CH=CH (etuna/asetilen)
ETUNA = ASETILEN => CH=CH
q Pembuatan : CaC2 + H2O ------à C2H2 + Ca(OH)2
q Sifat-sifat :
Ø Suatu senyawaan endoterm, maka mudah meledak
Ø Suatu gas, tak berwarna, baunya khas
q Penggunaan etuna :
Ø Pada pengelasan : dibakar dengan O2 memberi suhu yang tinggi (+- 3000oC), dipakai untuk mengelas besi dan baja
Ø Untuk penerangan
Ø Untuk sintesis senyawa lain
PEMBUATAN ALKUNA
Ø Dehidrohalogenasi alkil halida
Ø Reaksi metal asetilida dengan alkil halida primer
SENYAWA AROMATIK
q Senyawa alifatis : turunan metana
q Senyawa aromatis : turunan benzen (simbol Ar = aril)
q Permulaan abad ke-19 ditemukan senyawa-senyawa organik yang mempunyai bau (aroma) yang karakteristik yang berasal dari tumbuh-tumbuhan (damar benzoin, cumarin, asam sinamat dll)
BENZEN =C6H6
q Senyawa aromatis yang paling sederhana
q Berasal dari batu bara dan minyak bumi
q Sifat fisika : cairan, td. 80oC, tak berwarna, tak larut dalam air, larut dalam kebanyakan pelarut organik, mudah terbakar dengan nyala yang berjelaga dan berwarna (karena kadar C tinggi)
Pengunaan Benzen :
Ø Dahulu sebagai bahan bakar motor
Ø Pelarut untuk banyak zat
Ø Sintesis : stirena, fenol, nilon, anilin, isopropil benzen, detergen, insektisida, anhidrida asam maleat, dsb
ALKIL HALIDA
q Senyawa alkil halida merupakan senyawa hidrokarbon baik jenuh maupun tak jenuh yang satu unsur H-nya atau lebih digantikan oleh unsur halogen (X = Br, Cl. I)
q Alkil halida = haloalkana = RX struktur primer, sekunder, tersier
q Aril halida = ArX = senyawa halogen organik aromatik
Sifat fisika Alkil Halida :
¨ Mempunyai TD lebih tinggi dari pada TD Alkana dengan jumlah unsur C yang sama.
¨ Tidak larut dalam air, tapi larut dalam pelarut organik tertentu.
¨ Senyawa-senyawa bromo, iodo dan polikloro lebih berat dari pada air.
Struktur Alkil Halida : R-X (X=Br, Cl, I)
CH3-CH2-CH2-CH2-Cl (CH3)2CH-Br (CH3)3C-Br
Primer sekunder tersier

 CH2-Cl CH2=CH2-Cl
CH2-Cl CH2=CH2-Cl
Benzil khlorida Vinil khlorida
PEMBUATAN ALKIL HALIDA :
Ø Dari alkohol
Ø Halogenasi
Ø Adisi hidrogen halida dari alkena
Ø Adisi halogen dari alkena dan alkuna
PENGGUNAAN ALKIL HALIDA :
ä Kloroform (CHCl3) : pelarut untuk lemak, obat bius (dibubuhi etanol, disimpan dalam botol coklat, diisi sampai penuh).
ä Tetraklorometana = karbontetraklorida (CCl4) : pelarut untuk lemak, alat pemadam kebakaran (Pyrene, TD rendah 77oC, uapnya berat.
ä Freon (Freon 12 = CCl2F2, Freon 22 = CHCl2F) : pendingin lemari es, alat “air conditioner”, sebagai propellant (penyebar) kosmetik, insektisida, dsb.
ALKOHOL
q Alkohol : tersusun dari unsur C, H, dan O
q Struktur alkohol : R-OH primer, sekunder dan tersier
Sifat fisika alkohol :
· TD alkohol > TD alkena dengan jumlah unsur C yang sama (etanol = 78oC, etena = -88,6oC)
· Umumnya membentuk ikatan hidrogen
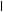
 O - H-----------------O - H
O - H-----------------O - H R R
· Berat jenis alkohol > BJ alkena
· Alkohol rantai pendek (metanol, etanol) larut dalam air (=polar)
Struktur Alkohol : R - OH
R-CH2-OH (R)2CH-OH (R)3C-OH
Primer sekunder tersier
PEMBUATAN ALKOHOL :
Ø Oksi mercurasi – demercurasi
Ø Hidroborasi – oksidasi
Ø Sintesis Grignard
Ø Hidrolisis alkil halida
PENGGUNAAN ALKOHOL :
ä Metanol : pelarut, antifreeze radiator mobil, sintesis formaldehid,metilamina,metilklorida,metilsalisilat, dll
ä Etanol : minuman beralkohol, larutan 70 % sebagai antiseptik, sebagai pengawet, dan sintesis eter, koloroform, dll
FENOL
q Fenol : mengandung gugus benzen dan hidroksi
q 
 Mempunyai sifat asam
Mempunyai sifat asam q  Mudah dioksidasi struktur OH
Mudah dioksidasi struktur OH q Mempunyai sifat antiseptik
q Penggunaan sbg antiseptikum dan sintesis
ETER
q Eter : isomer atau turunan dari alkohol (unsur H pada OH diganti oleh alkil atau aril)
q Eter : mengandung unsur C, H, dan O
Sifat fisika eter :
· Senyawa eter rantai C pendek berupa cair pada suhu kamar dan TD nya naik dengan penambahan unsur C.
· Eter rantai C pendek medah larut dalam air, eter dengan rantai panjang sulit larut dalam air dan larut dalam pelarut organik.
· Mudah terbakar
· Unsur C yang sama TD eter > TD alkana dan < TD alkohol (metil, n-pentil eter 100oC, n-heptana 98oC, heksil alkohol 157oC).
Struktur eter : R – O – R CH3-CH2-O-CH2-CH3 (dietil eter)
CH3-CH2-O-C6H5 (fenil etil eter)
PEMBUATAN ETER :
Ø Sintesis Williamson
Ø Alkoksi mercurasi – demercurasi
PENGGUNAAN ETER :
ä Dietil eter : sbg obat bius umum, pelarut dari minyak, dsb.
ä Eter-eter tak jenuh : pada opersi singkat : ilmu kedokteran gigi dan ilmu kebidanan.
AMINA
q Senyawa organik bersifat basa lemah, dibanding air lebih basa.
q Jumlah unsur C kecil sangat mudah larut dalam air.
Sifat fisika Amina :
· Suku-suku rendah berbentuk gas.
· Tak berwarna, berbau amoniak, berbau ikan.
· Mudah larut dalam air
· Amina yang lebih tinggi berbentuk cair/padat.
· Kelarutan dalam air berkurang dengan naiknya BM.
Struktur amina : R-NH2, (R)2NH, (R)3N =primer, sekunder, tersier
CH3-CH2-CH2-CH2-NH2 (CH3)2NH (CH3)3N
Primer sekunder tersier
Struktur Amina berdasarkan rantai gugus alkil/aril :
· Amina aromatis
· Amina alifatis
· Amina siklis
· Amina campuran
PEMBUATAN AMINA :
Ø Reduksi senyawa nitro
Ø Reaksi alkil halida dengan amonia dan amina
PENGGUNAAN AMINA :
ä Sebagai katalisator
ä Dimetil amina : pelarut, absorben gas alam, pencepat vulkanisasi, membuat sabun, dll.
ä Trimetil amina : suatu penarik serangga.
ALDEHID
q Aldehid adalah suatu senyawa yang mengandung gugus karbonil (C=O) yang terikat pada sebuah atau dua buah unsur hidrogen.
q Aldehid berasal dari “ alkohol dehidrogenatum “ (cara sintesisnya).
q Sifat-sifat kimia aldehid dan keton umumnya serupa, hanya berbeda dalam derajatnya. Unsur C kecil larut dalam air (berkurang + C).
q Merupakan senyawa polar, TD aldehid > senyawa non polar
q Sifat fisika formaldehid : suatu gas yang baunya sangat merangsang
q Akrolein = propanal = CH2=CH-CHO : cairan, baunya tajam, sangat reaktif.
FORMALDEHID = METANAL = H-CHO
¨ Sifat-sifat : satu-satunya aldehid yang berbentuk gas pada suhu kamar, tak berwarna, baunya tajam, larutanya dalam H2O dari 40 % disebut formalin.
¨ Penggunaan : sebagai desinfektans, mengeraskan protein (mengawetkan contoh-contoh biologik), membuat damar buatan.
Struktur Aldehid : R – CHO
PEMBUATAN ALDEHID :
Ø Oksidasi dari alkohol primer
Ø Oksidasi dari metilbenzen
Ø Reduksi dari asam klorida
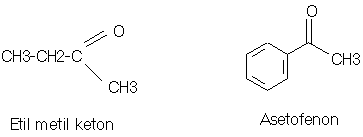
KETON
q Keton adalah suatu senyawa organik yang mempunyai sebuah gugus karbonil (C=O) terikat pada dua gugus alkil, dua gugus aril atau sebuah alkil dan sebuah aril.
q Sifat-sifat sama dengan aldehid.
PROPANON = DIMETIL KETON = ASETON = (CH3)2-C=O
¨ Sifat : cairan tak berwarna, mudah menguap, pelarut yang baik.
¨ Penggunaan : sebagai pelarut
ASETOFENON = METIL FENIL KETON
¨ Sifat : berhablur, tak berwarna
¨ Penggunaan : sebagai hipnotik, sebagai fenasil klorida (kloroasetofenon) dipakai sebagai gas air mata
Struktur : (R)2-C=O
PEMBUATAN KETON
Ø Oksidasi dari alkohol sekunder
Ø Asilasi Friedel-Craft
Ø Reaksi asam klorida dengan organologam
ASAM KARBOKSILAT
q Mengandung gugus COOH yang terikat pada gugus alkil (R-COOH) maupun gugus aril (Ar-COOH)
q Kelarutan sama dengan alkohol
q Asam dengan jumlah C 1 – 4 : larut dalam air
q Asam dengan jumlah C = 5 : sukar larut dalam air
q Asam dengan jumlah C > 6 : tidak larut dalam air
q Larut dalam pelarut organik seperti eter, alkohol, dan benzen
q TD asam karboksilat > TD alkohol dengan jumlah C sama.
Struktur Asam Karboksilat : R – COOH dan Ar – COOH
 CH3-CH2-CH2-CH2-COOH COOH
CH3-CH2-CH2-CH2-COOH COOH Valelat
CH3-COOH (asam asetat) Asam benzoat
ASAM FORMAT = HCOOH
¨ Sifat fisika : cairan, tak berwarna, merusak kulit, berbau tajam, larut dalam H2O dengan sempurna.
¨ Penggunaan : untuk koagulasi lateks, penyamakkan kulit, industri tekstil, dan fungisida.
ASAM ASETAT = CH3-COOH
¨ Sifat : cair, TL 17oC, TD 118oC, larut dalam H2O dengan sempurna
¨ Penggunaan : sintesis anhidrat asam asetat, ester, garam, zat warna, zat wangi, bahan farmasi, plastik, serat buatan, selulosa dan sebagai penambah makanan.
PEMBUATAN ASAM KARBOKSILAT
Ø Oksidasi alkohol primer
Ø Oksidasi alkil benzen
Ø Carbonasi Reagen Grignard
Ø Hidrolisin nitril
AMIDA
q Amida adalah turunan asam karboksilat, dimana gugus –OH digan-ti dengan –NH2 atau amoniak, dimana 1 H diganti dengan asil.
q Sifat fisika : zat padat kecuali formamida yang berbentuk cair, tak berwarna, suku-suku yang rendah larut dalam air, bereaksi kira-kira netral.
Struktur Amida : R – CONH2
PEMBUATAN AMIDA :
Ø Reaksi asam karboksilat dengan amoniak
Ø Garam amoniumamida dipanaskan
Ø Reaksi anhidrid asam dengan amponiak
PENGGUNAAN AMIDA :
ä Formamida berbentuk cair, sebagai pelarut.
ä Untuk identifikasi asam yang berbentuk cair.
ä Untuk sintesis nilon, ds.
ESTER
q Ester adalah turunan asam karboksilat, dimana gugus H pada –OH diganti dengan gugus R.
q Sifat fisika : berbentuk cair atau padat, tak berwarna, sedikit larut dalm H2O, kebanyakan mempunyai bau yang khas dan banyak terdapat di alam.
Struktur ester : R – COOR
PEMBUATAN ESTER :
Ø Reaksi alkohol dan asam karboksilat
Ø Reaksi asam klorida atau anhidrida
PENGGUNAAN ESTER :
ä Sebagai pelarut, butil asetat (pelarut dalam industri cat).
ä Sebagai zat wangi dan sari wangi.






































 Mawar PINK : Melambangkan feminitas, kelembutan dan kehalusan, Mawar Pink juga memiliki makna lain bergantung pada kekentalan warnanya. Pink tua mengungkapkan rasa terima kasih dan penghargaan, pink muda mengungkapkan kehalusan dan kelembutan, kekaguman dan kegembiraan.
Mawar PINK : Melambangkan feminitas, kelembutan dan kehalusan, Mawar Pink juga memiliki makna lain bergantung pada kekentalan warnanya. Pink tua mengungkapkan rasa terima kasih dan penghargaan, pink muda mengungkapkan kehalusan dan kelembutan, kekaguman dan kegembiraan. Mawar ORANGE : Dengan warna hangat dan vibrant tones, Mawar Orange mencerminkan hasrat dan antusiasme. Jika Anda mencari cara untuk mengungkapkan kekaguman dan ketertarikan dengan pesan di baliknya, gairah dan ketertarikan, kirim saja buket berisi mawar orange mekar.
Mawar ORANGE : Dengan warna hangat dan vibrant tones, Mawar Orange mencerminkan hasrat dan antusiasme. Jika Anda mencari cara untuk mengungkapkan kekaguman dan ketertarikan dengan pesan di baliknya, gairah dan ketertarikan, kirim saja buket berisi mawar orange mekar. Mawar UNGU : Dianggap memiliki sifat mistis, dengan simbolisme kecantikan yang menggoda dan gairah, tidak mengherankan mawar Ungu dapat menyiratkan pesan cinta pada pandangan pertama. Mawar yang sangat bagus untuk Valentine.
Mawar UNGU : Dianggap memiliki sifat mistis, dengan simbolisme kecantikan yang menggoda dan gairah, tidak mengherankan mawar Ungu dapat menyiratkan pesan cinta pada pandangan pertama. Mawar yang sangat bagus untuk Valentine. Mawar BIRU : dulunya mawar ini tidak ada yang natural namun sekarang mawar biru natural sudah terciptakan melalui persilangan warna. Mawar ini melambangkan mengenai misteri atau sesuatu yang diinginkan namun tak bisa diraih.
Mawar BIRU : dulunya mawar ini tidak ada yang natural namun sekarang mawar biru natural sudah terciptakan melalui persilangan warna. Mawar ini melambangkan mengenai misteri atau sesuatu yang diinginkan namun tak bisa diraih. Mawar PEACH : melambangkan mengenai berbagai maksud yang berbeda seperti penghargaan, apresiasi, kekaguman, atau simpati. Juga bisa melambangkan persahabatan.
Mawar PEACH : melambangkan mengenai berbagai maksud yang berbeda seperti penghargaan, apresiasi, kekaguman, atau simpati. Juga bisa melambangkan persahabatan.